がん悪液質という言葉をご存知でしょうか。がん患者さんの約半数以上が経験する症状です。
この記事では悪液質の詳細や診断基準、ステージ分類について学んでいただきたいと思います。
また、悪液質の特徴である筋肉減少についてのメカニズムを述べています。
少し難しいと感じるかもしれませんが、最後まで読んで下さい。
最後のまとめで分かりやすくまとめています。
がんと筋肉減少
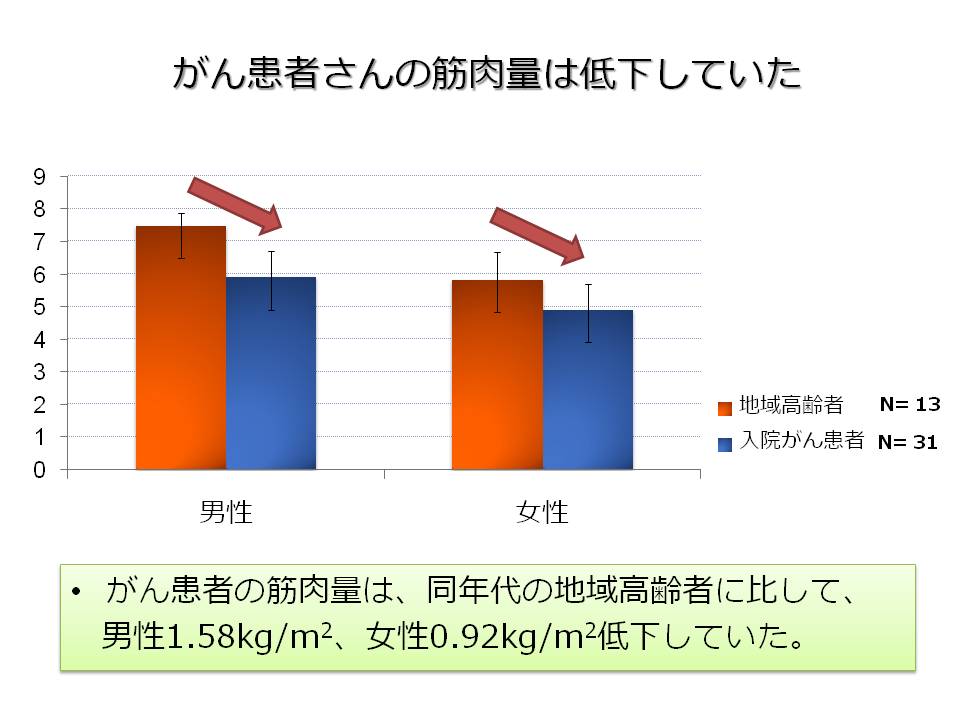
私は病院でがん患者さんの筋肉量を調べた事があります。
地域のサロンに通う高齢者と、がんで入院した方の筋肉量を比較しました。
活動量などの違いはあれど、同年齢で比較しますと、がん患者さんの筋肉量は少ない事がわかりました。
その原因は、がん特有の症状である、悪液質にあると考えています。
がん悪液質
悪液質(カヘキシア:Cachexia)とは体重減少、全身倦怠感、消耗状態などをきたし、栄養管理では改善されない状態です。
「がん悪液質は脂肪量の減少を伴うまたは伴わない筋肉の減少を特徴とする」と定義されています。
その本態は全身の炎症を伴った代謝異常と考えられています。
食欲不振によるエネルギー摂取の低下と慢性炎症を伴うサイトカインの異常によるエネルギー消費の増大が病態の基本です。
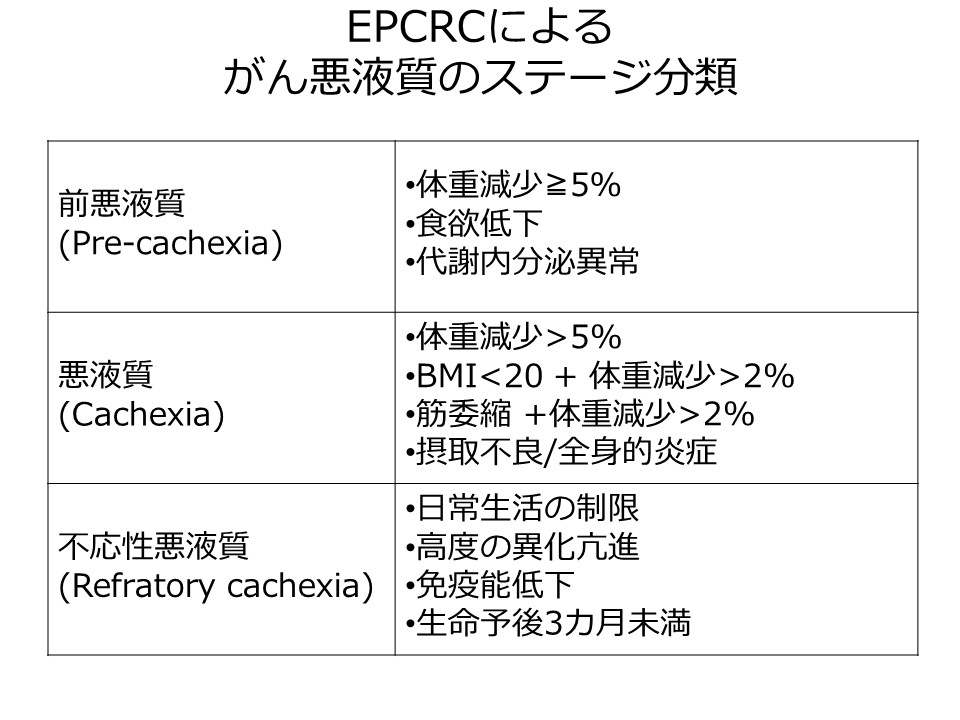
がん悪液質の診断基準

がん悪液質のステージ分類
悪液質の病態
1.代謝亢進
がん患者さんの約半数が安静時エネルギー消費量(REE)が亢進した状態にあると言われています。がん細胞は大量のブドウ糖を消費し、エネルギーの一部に変換して活動しています。一方で体内のブドウ糖は筋肉の活動や脳の栄養としても利用されます。しかし、がん患者さんは活動量が落ちてしまうので、がん細胞がエネルギーを消費したとしても、活動時エネルギーの消費量が低下してしまい、総エネルギー消費量は変わらない(保たれる)です。
(がんの運動療法で述べていますが)筋力トレーニングを行うことで、がん細胞でエネルギーとして利用されるブドウ糖を筋肉で消費させ、がん細胞へのエネルギーを少しでも枯渇させる可能性があります。
2.糖代謝異常
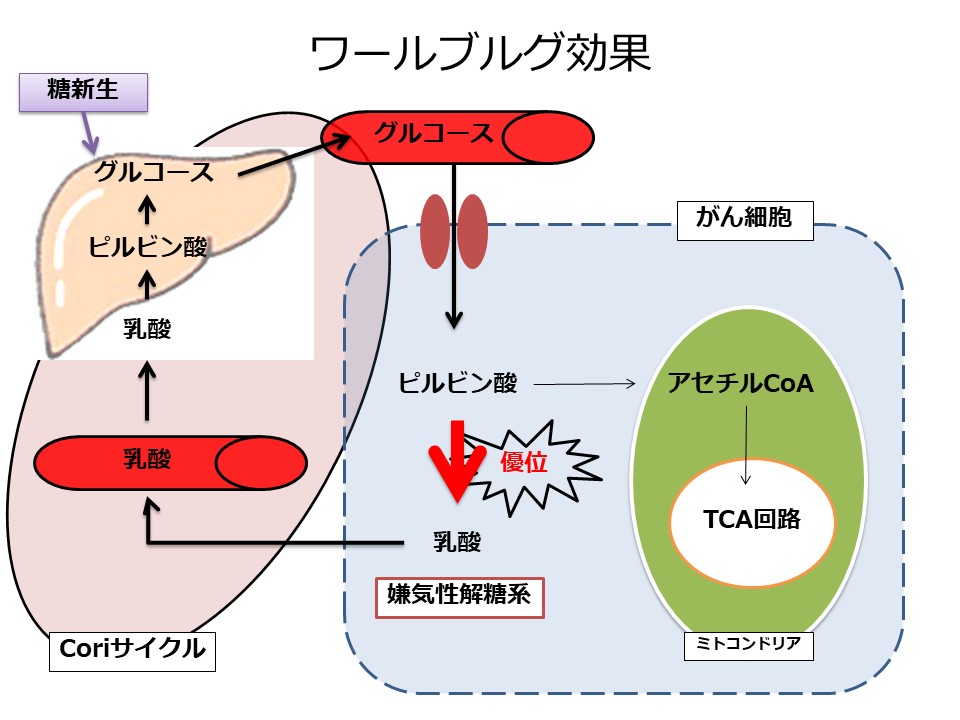
がん細胞は組織の低酸素状態やがん遺伝子の活性によりグルコース消費が亢進しています。がん細胞は有酸素下でもミトコンドリアの酸化的リン酸化よりも、解糖系でATPを産生します。グルコースは解糖系で代謝された後にミトコンドリアに入ることなく,乳酸に変換されます。これをWarburg効果と呼びます。がん細胞内で産生した乳酸は肝臓で糖新生に利用され、再びグルコースに変換されがん細胞に取り込まれます。(Coriサイクル)
肝臓の糖新生には1分子あたり6分子のATP(アデノシン三リン酸)が使用されることになり、1日300kcalが余分に消費されていることになります。
3.蛋白代謝異常
がん悪液質では骨格筋が選択的に減少し、肝臓などの内臓タンパクは比較的保たれます。筋肉の減少については、後述します。
4.脂質代謝異常
がん悪液質では脂肪分解と脂肪合成の抑制が起こり、体脂肪が減少します。また、がん細胞が副甲状腺ホルモン関連蛋白を産生し、白色脂肪細胞をベージュ細胞に変換し、エネルギー消費を亢進させることも注目されています。
がん悪液質と筋力低下
筋肉の同化と異化
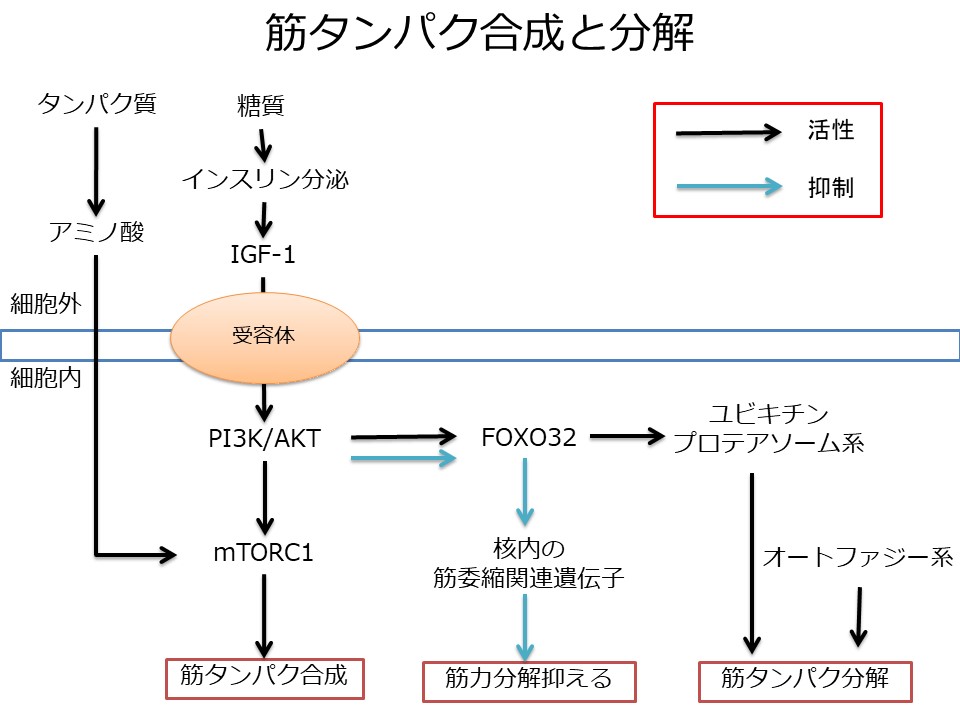
筋肉量はタンパク質合成と異化の相対速度によって制御されます。
合成経路
主要な同化経路は、インスリン、IGF-1およびその他増殖因子によって活性化される標準的PI3K/AKT経路です。
哺乳動物標的(mTORC1)であるPI3K/AKTの下流では、筋肥大が誘発されます。mTORC1の活性はmRNAの翻訳とアポトーシスの制御を刺激し、細胞の大きさと数の増加を引き起こします。
分解経路
骨格筋の分解には、自食作用およびユビキチン・プロテアソーム系が含まれる。自食作用は損傷を受けた細胞小器官およびタンパク質が分解される非選択的異化経路です。
筋肉特異的ユビキチンリガーゼは、筋肉構造タンパク質および収縮タンパク質の分解を標的とする主な酵素と考えられており、これらにはTRIM63(筋肉特異的RINFフィンガータンパク質1)およびFOXO32(筋委縮F-Boxタンパク質)としても知られています。
たんぱく質の重要性に関してもっと知りたい方は、こちらの記事を参考に。
![]()
がんと筋肉減少
がん患者では、複雑な炎症性、内分泌性および栄養関連の影響の結果として、筋肉タンパク質の合成の低下および異化作用の活性が起こります。
免疫系-腫瘍相互作用によって産生されるサイトカインおよび他の炎症誘発性分子がその中心的役割を果たすと考えられています。
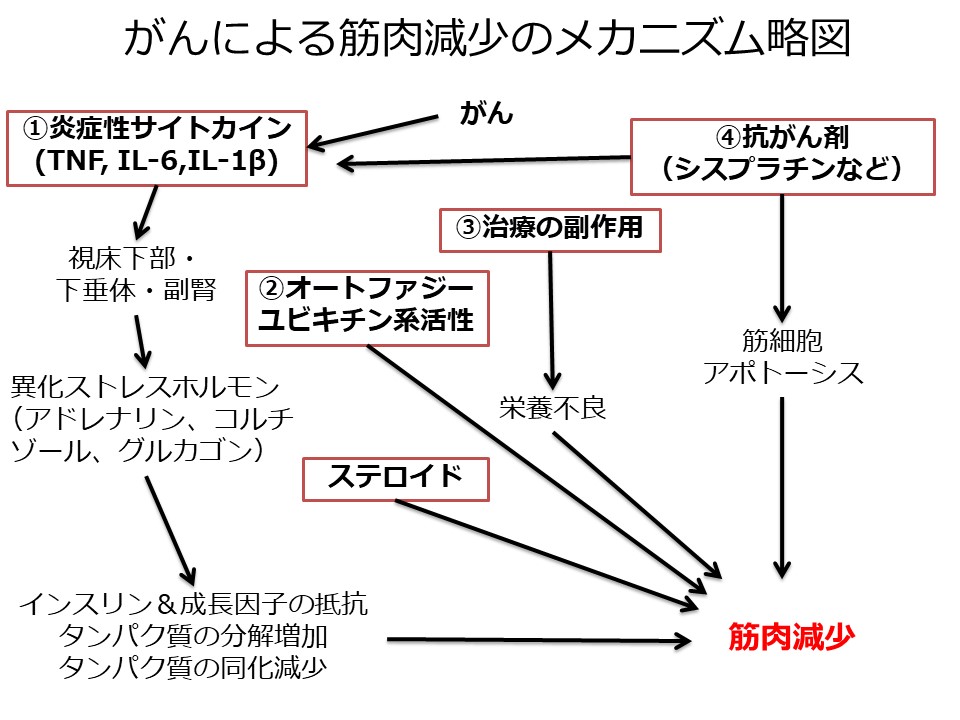
①誘発性サイトカインは、視床下部-下垂体-副腎の系を活性化し、異化ストレスホルモン(アドレナリン、コルチゾール、グルカゴン)の産生をもたらし、筋肉に対するインスリンおよび成長因子に対する抵抗性、タンパク質分解の増加およびタンパク質同化の減少を引き起こします。
②オートファジーおよびユビキチン-プロテアソーム系の転写アップレギュレーションは、腫瘍、免疫系またはその両方に由来する一連の前炎症性作用物質によって筋細胞において直接活性化されます。
筋肉異化作用のサイトカインメディエーターには、IL-6、IL-1、TNF-α、インターフェロンγ白血病抑制因子、TNFリガンドスーパーファミリーメンバー12(TWEAK)が含まれます。これらの因子は、それぞれの細胞表面受容体を介してシグナルを伝達し、ユビキチンプロテアソームとオートファジー遺伝子の転写を活性化します。
③標準化学療法または科学放射線療法により4-12kgの体重減少がおこります。これは、画像診断では大部分が筋肉の喪失であることが多いと明らかになっています。
少なくとも多くのがん治療は、食欲不振、口腔粘膜炎、口渇、早期満腹感、吸収不良、下痢、嘔吐、悪心などの胃腸の副作用を介して筋肉量減少を誘発してしまいます。さらにがん治療の間は疼痛、不安、うつ、睡眠の変化、疲労、内分泌障害など、摂食不良の一因となる問題が多く存在します。
栄養不足は筋肉細胞の異化反応の促進に繋がります。例えば、アミノ酸(分岐アミノ酸ロイシン)は筋肉中のタンパク質の同化作用を促進しますが(そして異化作用を減少させる)、低栄養によるアミノ酸不足は、ユビキチン系の活性化、自食作用およびアポトーシスを促進させ、筋肉の異化作用を進行させます。
最近では、細胞障害性および分子標的薬の抗がん剤治療が、筋細胞に直接影響を与えていること明らかになりつつあります。その影響は、筋収縮性の変化、インスリン抵抗性、筋委縮などです。これらの副作用はとてもやっかいであり、理解も不十分です。多くのがんは、mTORC1の上流の経路において異常な活性化を示しています。このため標的型がん治療はMTORC1複合体(シロリムス、エベロリムス、リダフォロリムス)を対象として設計されています。残念なことに、筋肉タンパク質合成は、腫瘍細胞が増殖に依存するmTORC1依存性経路を介してインスリンおよびアミノ酸によって活性されるので、mTORC1複合体の異常な活性により予測される効果は筋委縮となります。
④さらに、いくつかの細胞傷害性抗がん剤(オキサリプラチン、シスプラチン、アントラサイクリン、5-フルオロウラシル、イリノテカン)は、筋細胞により取りこまれ、タンパク質分解およびアポトーシスシグナル伝達、ミトコンドリア機能障害、酸化的損傷、細胞エネルギー枯渇およびアポトーシスまたは壊死性細胞死を誘導します。ゲムシタビン+シスプラチン療法を受けているマウスでは、骨格筋はTGFαファミリーリカンドのミオスタチンおよびアクチビンA、炎症誘発性サイトカインTNF-α、IL-6およびIl-1β、ならびにユビキチンリガーゼTRIM63およびFBXO32およびプロテアソームの発現を示しました。
筋肉に対するがん治療薬のこれらの直接的な影響は、がん治療の重大な有害作用となります。
がん悪液質と筋肉減少まとめ
分子レベルの少し小難しいお話になってしまいました。簡単にまとめます。
がん細胞は糖を栄養に活動しており、消費した糖を肝臓で再構築して活動しています。
がん細胞は炎症性サイトカインを異常に産生することで、筋肉減少を引き起こしています。
また、体脂肪も減らします。
これらが異常な体重減少を引き起こし、飢餓状態となる悪循環を生みだしています。
がんの筋肉量減少には、ホエイプロテインアイソレート(WPI)が効果的という報告もあります。
詳しくは、こちらの記事(がんとWPI)を参考にされてください!
Vickie E. Baracos.:Cancer cachexia is defined by an ongoing loss of skeletal muscle mass.APM:Vol8, No1.2019.
武田宏司.やせと疾患:壮年期-癌・悪液質, 消化管手術, ストレス-.肥満研究:vol23(3).2017.

コメント
[…] 詳しくはこちら☞悪液質と筋肉減少 […]
[…] […]